Du får nok mere ud af at læse om det på wikipedia el. lign., men jeg kan da stadig prøve at forklare lidt om det.
Normalt opskrives kemiske formler entydigt, dvs. med bindinger mellem de enkelte atomer. De enkelte bindinger repræsenterer hvor der mellem to atomer deles elektroner - f.eks. repræsenterer en enkeltbinding at der mellem to atomer deles ét elektronpar (altså to elektroner), en dobbeltbinding at der deles to elektronpar (fire elektroner) og en trippelbinding, at der deles tre elektronpar (seks elektroner). Problemet er imidlertid at mange reaktioner og forskellige strukturer ikke altid er logiske, hvis man kun gør brug af "bindingsmodellen". Hvorfor er forskellige ioner mere stabile end andre, og hvorfor besidder visse organiske syrer og baser den styrke de har? Hvorfor er f.eks. ortho/para stillingen favorabel når man halogenerer eller hydroxylerer en benzenring, hvorimod meta-stillingen er favorabel ved nitrering eller carboxylering?
Visse kemiske formler er ikke entydige dvs. en korrekt fysisk/kemisk afspejling af hvordan stoffet på et molekylært plan ser ud. Tager man benzen f.eks., opskrives det somregel som en 1,3,5-cyklohexatrien, men sandheden er at hver enkelt dobbelbinding ikke direkte er et udtryk for at der netop mellem to carbon-atomer deles to elektronpar. Snarere er sagen, at alle de elektroner der indgår i bindingerne mellem de seks carbonatomer, bevæger sig frit rundt i atomernes orbitaler (via p-orbiatal overlap). Man kan altså simplificeret sige, at resonansstrukturer er en illustration af, hvordan elektronerne bevæger sig rundt mellem de enkelte atomer. Ioniseres et stof f.eks. med en syre eller base, opstår der en ladning på det elektrofile eller nukleofile atom. Denne ladning "forbliver" ikke på det bestemte atom, men bevæger sig rundt i molekylet, i så fald der er mulighed for det. For store ladningsforskelle i et molekyle er nemlig uhensigtsmæssigt og gør det ustabilt - derfor udjævnes den samlede ladning ved at elektroner bevæger sig rundt i systemet og således "lukker" den ujævnhed der er opstået.
Som eksempel kan tages ethanol og ethansyre (eddikesyre). Hvor eddikesyre har en pKa på ~ 4,75 har ethanol en pKa på ~ 16. Fra kendskab til at pKa-skalaen er en logaritmisk skala, kan vi se at eddikesyre altså er en over 100 milliarder gange stærkere syre end alkohol (1,76 x 10[sup]11[/sup]). Og hvorfor så det?
Fordi eddikesyres korresponderende base (acetat) er resonansstabiliseret, hvorimod ethanols (ethanolat) ikke er. Illustreret ser det således ud:
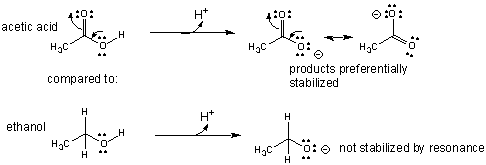
Et af grundprincipperne i organisk kemi er, at jo flere resonansformer et molekyle har, jo mere stabilt er det. Fordi acetat er resonansstabiliseret som vist ovenover er den mere stabil end ethanolat. Ligevægten mellem to former af et stof - henholdsvis syre el. baseform, er bestemt af stabiliteten af de enkelte strukturer. Ethanolat har ingen resonansstrukturer, så den forbindelse er meget ustabil, og således er den form ikke særlig favorabel. Derfor vil stoffet hellere forblive på sin syreform, altså som ethanol. Modsat er acetat langt mere stabil og ligevægten mellem eddikesyre og acetat er derfor i højere grad forskudt mod baseformen, i forhold til ethanol og ethanolat. Omvendt kan så siges at fordi ethanolat-ionen er så ustabil er den også en uhyre stærk base (og har i så fald også en meget lav pkb værdi).
Dog er resonansstabiliseringen ikke den eneste årsag til at et stof besidder visse syre/base egenskaber. Ethanolat er en stærk base fordi den negative ladning er lokaliseret på O-atomet, og er derfor meget villig til at dele sin ene overskydende elektron med en proton (og således få O-H bindingen). Omvendt er acetat-ionens negative ladning delokaliseret dvs. fordelt mellem C-OH bindingen og C=O bindingen. Det gør den samlede ladning på det nukleofile O-atom mindre, og således mindre reaktionsvillig (og dermed også svagere base).
Håber det gav lidt klarhed






